Chemical Equilibrium
สมดุลเคมี คือสภาวะที่ความเข้มข้นของสารตั้งต้นและสารผลิตภัณฑ์ไม่เปลี่ยนแปลงอีกแม้เวลาผ่านไป เราจะเรียกว่าปฏิกิริยาเคมีนั้นอยู่ในสมดุล ทั้งนี้ การดำเนินไปของปฏิริยาไม่ได้สิ้นสุดลงแต่ระบบยังคงมีการเปลี่ยนแปลงอยู่ตลอดเวลา เรียกว่า สมดุลไดนามิก
กระบวนการเปลี่ยนแปลงทางวิทยาศาสตร์มี 3 รูปแบบ คือ การเปลี่ยนสถานะ การละลาย และการเกิดปฏิกิริยาเคมี จำแนกเป็น 2 ลักษณะคือ
ในการเกิดปฏิกิริยานี้ ก๊าซ H2 และ N2 เป็นสารตั้งต้น ทำปฏิกิริยากันกลายเป็นก๊าซ NH3 และในทันทีที่เกิดก๊าซ NH3 ก๊าซ NH3 ที่เกิดขึ้นจะสลายตัวกลับไปเป็นก๊าซ H2 และ N2 อย่างเดิม ฉะนั้นในเวลาเดียวกันจึงมีการเปลี่ยนแปลงเกิดขึ้น 2 กระบวนการพร้อมกัน ได้แก่
2.1 ก๊าซ H2 กับ N2 ทำปฏิกิริยากันกลายเป็นก๊าซ NH3 ดังสมการ
3 H2(g) + N2(g) → 2NH3(g)
กระบวนการนี้เกิดขึ้นก่อน เรียกว่าการเปลี่ยนแปลงไปข้างหน้า (forward change หรือ forward reaction)
2.2 ก๊าซ NH3 บางส่วนสลายตัวกลับมาเป็นก๊าซ H2 กับ N2 ตามเดิม ดังสมการ
2NH3(g) → 3H2(g) + N2(g)
กระบวนการนี้เกิดขึ้นทีหลัง เรียกว่าการเปลี่ยนแปลงย้อนกลับ (reverse change หรือ reverse reaction) เมื่อนำการเปลี่ยนแปลงทั้ง 2 มาเขียนไว้ในสมการเดียวกัน รูปของสมการจะเป็นดังนี้
2NH3(g) ⇌ 3H2(g) + N2(g)
คุณสมบัติของสมดุลเคมี
- สมดุลเคมีจะต้องเกิดในระบบปิดเท่านั้น
- สมดุลจะต้องเกิดการเปลี่ยนแปลงที่ผผันกลับได้
- ค่าอัตราการเกิดของปฏิกิริยาไปข้างหน้าจะเท่ากับค่าอัตราการเกิดปฏิกิริยาไปข้างหลัง
- ในทุกๆ ระบบจะมีสารตั้งต้นเหลืออยู่
- ค่าของระบบนั้นๆจะคงที่
ภาวะสมดุล หมายถึง ภาวะที่ระบบมีสมบัติคงที่ หรือภาวะที่สารตั้งต้นและสารผลิตภัณฑ์ทุกชนิดมีปริมาณหรือความเข้มข้นคงที่ หรือภาวะที่อัตราการเปลี่ยนแปลงไปข้างหน้าเท่ากับอัตราการเปลี่ยนแปลงย้อนกลับ
สมบัติของระบบ ณ ภาวะสมดุล
-
ต้องเป็นปฏิกิริยาที่ผันกลับได้ โดย ต้องเกิดในระบบปิด
-
มีปฏิกิริยาไปข้างหน้าและย้อนกลับเกิดขึ้นตลอดเวลา โดยจำนวนโมลของสารตั้งต้นและผลิตภัณฑ์คงที่แต่อาจเท่ากันหรือไม่เท่ากันก็ได้ และ อัตราการเกิดปฏิกิริยาไปข้างหน้าเท่ากับปฏิริยาย้อนกลับ
-
สมบัติของระบบคงที่ (จำนวนโมลคงที่ สีของสารคงที่ ความดันคงที่ และอุณหภูมิคงที่)
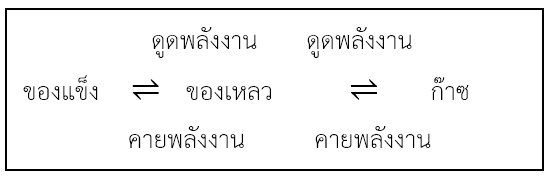
ภาวะสมดุลระหว่างสถานะ สารต่างๆสามารถเปลี่ยนสถานะได้ โดยมีการเปลี่ยนแปลงพลังงานควบคู่ไปด้วย ดังแผนภาพนี้
ที่ภาวะสมดุลของปฏิกิริยาเคมีระบบยังมิได้หยุดนิ่ง ยังมีทั้งการเกิดปฏิกิริยาไปข้างหน้า และเกิดปฏิกิริยาย้อนกลับตลอดเวลาโดยเกิดในอัตราที่เท่ากัน เรียกภาวะสมดุลนี้ว่า ภาวะสมดุลไดนามิก
ภาวะสมดุลในสารละลายอิ่มตัว เมื่อให้ตัวถูกละลาย ละลายในตัวทำละลาย ตัวถูกละลายก็จะละลายได้เร็วในตอนแรกแล้วละลายได้ช้าลงและเมื่อเกิดสารละลายอิ่มตัว เราจะพบว่าตัวถูกละลายไม่ละลายต่อไปอีก ไม่ว่าจะคนสารละลายเป็นเวลานานเท่าใดถ้าอุณหภูมิคงที่ เมื่อตั้งสารละลายอิ่มตัวไว้จะเกิดผลึกขึ้นและปริมาณของผลึกจะเพิ่มขึ้นเรื่อยๆจนในที่สุดผลึกคงที่ เรายังดูเหมือนว่าไม่เกิดผลึกอีก แต่ในระบบผลึกยังคงเกิดขึ้นเรื่อยๆแล้วก็ละลายในสารละลายอีกด้วย
สมดุลในปฏิกิริยาเคมี คือ ปฏิกิริยาเคมีที่เกิดภาวะสมดุลจะต้องเป็นปฏิกิริยาผันกลับได้ และ สมบัติของระบบต้องคงที่ การศึกษาภาวะสมดุลของปฏิกิริยาเคมี ตรวจสอบดังนี้
-
ทดสอบปฏิกิริยาไปข้างหน้า (สารตั้งต้นทำปฏิกิริยากันแล้วเกิดเป็นสารผลิตภัณฑ์หรือไม่)
-
ทดสอบปฏิกิริยาย้อนกลับ (นำสารผลิตภัณฑ์มาทำปฏิกิริยากันแล้วกลับไปเป็นสารตั้งต้นหรือไม่)
-
สังเกตสมบัติของระบบว่าคงที่หรือไม่ (อาจสังเกตสีว่าคงที่หรือไม่)
การเปลี่ยนแปลงที่ก่อให้เกิดสมดุลเคมีต้องเป็นการเปลี่ยนแปลงที่ผันกลับได้ ซึ่งแบ่งเป็น 3 ประเภท ดังนี้
1. การเปลี่ยนสถานะ
เช่น การกลายเป็นไอของน้ำในภาชนะปิด น้ำเปลี่ยนสถานะจากของเหลวเป็นแก๊ส
H2O(l) ⇌ H2O(g)
หรือการระเหิดของไอโอดีนในภาชนะปิด ซึ่งเปลี่ยนสถานะไอโอดีนจากของแข็งเป็นแก๊ส
I2(s) ⇌ I2 (g)
ดังนั้น ในระบบอาจมีการเปลี่ยนสถานะจากของแข็งเป็นของเหลว หรือจากของเหลวเป็นแก๊ส หรือจากแก๊สเป็นของแข็งอย่างใดอย่างหนึ่ง ดังนั้นการเปลี่ยนสถานะที่จะก่อให้เกิดสมดุลเคมีได้ต้องเกิดในระบบปิดเท่านั้น
2. การเกิดสารละลาย
การเกิดสารละลายที่จะก่อให้เกิดสมดุลเคมี เช่น การละลายของเกลือ NaCl ในน้ำได้สารละลาย แต่เมื่อให้ความร้อนจะเกิดเป็นสารละลายอิ่มตัว เมื่ออุณหภูมิลดลงจะเกิดการตกผลึกของเกลือ NaCl กลับมา การเกิดสารละลายลักษณะนี้จึงก่อให้เกิดการเปลี่ยนแปลงที่ผันกลับได้ การละลายของเกลือแกงแสดงดังสมการข้างล่าง(จะต้องละลายจนอิ่มตัวจึงจะเกิดสมดุล)
NaCl (s) + H2O ⇌ Na+(aq) + Cl- (aq)
3. การเกิดปฏิกิริยาเคมี
การเกิดปฏิกิริยาบางปฏิกิริยาสามารถผันกลับได้ และก่อให้เกิดสมดุลเคมี เช่น การละลายของก๊าซ CO2 ในน้ำ อาจจะเกิดการเปลี่ยนแปลงในลักษณะการแพร่ของแก๊ส CO2 ในน้ำ หรืออาจเกิดปฏิกิริยาเคมีกับน้ำได้กรดคาร์บอนิก และกรดคาร์บอนิกสามารถสลายตัวกลับมาเป็นแก๊ส CO2 และ H2O เหมือนเดิม
CO2 (g) + H2O (l) ⇌ H2CO3
หลักของเลอชาเตลิเย
ใน พ.ศ. 2427 อ็องรี หลุยส์ เลอ ชาเตอลิเยร์ (Le Chatelier, Henry-louis) ได้ให้ข้อมูลสรุปการศึกษาการค้นคว้าเกี่ยวกับการเปลี่ยนแปลงสภาสมดุลของปฏิกิริยาต่างๆไว้ดังนี้ “เมื่อระบบที่อยู่ในภาวะสมดุลถูกรบกวนโดยการเปลี่ยนแปลงปัจจัยที่มีผลต่อภาวะสมดุลขอระบบ ระบบจะเกิดการเปลี่ยนแปลงไปในทิศทางที่จะลดผลของการรบกวนนั้น เพื่อให้ระบบเข้าสู่ภาวะสมดุลอีกครั้ง”
โดยระบบที่อยู่ในภาวะสมดุลมีสมบัติต่างๆของระบบคงที่ เช่น ความเข้มข้นของสารตั้งต้นและสารผลิตภัณฑ์คงที่ ความดันของระบบคงที่ อัตราการเกิดปฏิกิริยาไปข้างหน้าเท่ากับอัตราการเกิดปฏิกิริยาย้อนกลับ เป็นต้น การรบกวนภาวะสมดุลของระบบโดยการเปลี่ยนแปลงสภาวะของสารในปฏิกิริยา อาจทำให้ค่าคงที่ของสมดุลและตำแหน่งของภาวะสมดุลเปลี่ยนไป หรืออาจทำให้ระบบเข้าสู่ภาวะสมดุลได้เร็วขึ้นหรือช้าลง
การเปลี่ยนแปลงความเข้มข้นของสาร
การเพิ่มความเข้มข้นของสาร เป็นการเพิ่มจำนวนโมเลกุลของสารที่เข้าทำปฏิกิริยาให้มีโอกาสชนกันมากขึ้น ทำให้อัตราการเกิดปฏิกิริยาเพิ่มขึ้น แต่การลดความเข้มข้นของสารเป็นการลดจำนวนโมเลกุลของสารที่เข้าทำปฏิกิริยา ทำให้อัตราการเกิดปฏิกิริยาลดลง
การเปลี่ยนแปลงความเข้มข้นของสารในปฏิกิริยาเคมี โดยทั่วไปมีผลต่อภาวะสมดุลของระบบดังนี้
-
การเพิ่มความเข้มข้นของสารตั้งต้นสารใดสารหนึ่ง สมดุลจะเลื่อนไปทางขวา และเมื่อเพิ่มความเข้มข้นของสารผลิตภัณฑ์สารใดสารหนึ่ง สมดุลจะเลื่อนไปทางซ้าย
-
การลดความเข้มข้นของสารตั้งต้นสารใดสารหนึ่ง สมดุลจะเลื่อนไปทางซ้าย และเมื่อลดความเข้มข้นของสารผลิตภัณฑ์สารใดสารหนึ่ง สมดุลจะเลื่อนไปทางขวา
-
สารที่มีสถานะเป็นของแข็ง (s) หรือของเหลวบริสุทธิ์ (l) จะไม่มีผลต่อภาวะสมดุลของระบบ เนื่องจากมีค่าความเข้มข้นคงที่
โดยเมื่อเปลี่ยนความเข้มข้นของสารในระบบ ภาวะสมดุลของระบบจะเปลี่ยนแปลงด้วย แต่ไม่มีผลต่อค่าคงที่สมดุลของระบบ คือ ค่าคงที่สมดุลของระบบจะมีค่าคงที่ถึงแม้ว่าจะเพิ่มหรือลดความเข้มข้นของสารตั้งต้นหรือผลิตภัณฑ์ก็ตาม
การเปลี่ยนแปลงความดันของระบบ
การเปลี่ยนแปลงความดันหรือปริมาตรจะมีผลต่อภาวะสมดุลก็ต่อเมื่อ
-
ต้องเป็นภาวะสมดุลของระบบที่มีสารอย่างน้อยหนึ่งชนิดเป็นแก๊ส ถ้าเป็นระบบที่มีสารตั้งต้นและสารผลิตภัณฑ์เป็นของแข็งหรือของเหลว การเปลี่ยนแปลงความดันจะไม่มีผลต่อภาวะสมดุลของระบบ
-
จำนวนโมลของสารตั้งต้นที่เป็นแก๊ส ต้องไม่เท่ากับจำนวนโมลของสารผลิตภัณฑ์ที่เป็นแก๊ส
โดยการเปลี่ยนแปลงความดันกับภาวะสมดุลของระบบที่มีแก๊สเกี่ยวข้องและจำนวนโมลของแก๊สตั้งต้น และจำนวนโมลของแก๊สผลิตภัณฑ์ต้องไม่เท่ากัน การเปลี่ยนแปลงความดันจะมีผลในการทำให้ภาวะสมดุลเปลี่ยนไป คือ
- การเพิ่มความดัน เมื่อเพิ่มความดันให้แก่ระบบ (ลดปริมาตรของระบบ) ระบบจะปรับตัวไปในทิศทางลดความดัน โดยการลดจำนวนโมลหรือโมเลกุลของระบบลง เพราะความดันเป็นสัดส่วนโดยตรงกับจำนวนโมลหรือโมเลกุล ดังนั้นการเพิ่มความดันจะทำให้ปฏิกิริยาเกิดไปทางด้านที่มีจำนวนโมลหรือโมเลกุลของแก๊สที่มีจำนวนโมลน้อยกว่าได้ดีขึ้น ที่ภาวะสมดุลใหม่ความเข้มข้นของสารจะต่างจากภาวะสมดุลเดิม
- การลดความดัน เมื่อลดความดันให้แก่ระบบ (เพิ่มปริมาตรของระบบ) ระบบจะปรับตัวไปในทิศทางเพิ่มความดัน โดยการเพิ่มจำนวนโมลหรือโมเลกุลของระบบลง เพราะความดันเป็นสัดส่วนโดยตรงกับจำนวนโมลหรือโมเลกุล ดังนั้นการลดความดันจะทำให้ปฏิกิริยาเกิดไปทางด้านที่มีจำนวนโมลหรือโมเลกุลของแก๊สที่มีจำนวนโมลมากกว่าได้ดีขึ้น ที่ภาวะสมดุลใหม่ความเข้มข้นของสารจะต่างจากภาวะสมดุลเดิม
กรณีการเปลี่ยนความดันกับภาวะสมดุลของระบบที่มีแก๊สเข้ามาเกี่ยวข้อง แต่มีจำนวนโมลของสารตั้งต้นที่เป็นแก๊สเท่ากับจำนวนโมลของสารผลิตภัณฑ์ที่เป็นแก๊ส การเพิ่มหรือลดความดันจะไม่มีผลต่อภาวะสมดุลของระบบ เพราะจำนวนโมลของสารตั้งต้นที่เป็นแก๊สเท่ากับจำนวนโมลของสารผลิตภัณฑ์ที่เป็นแก๊สเท่ากัน ดังนั้นไม่ว่าจะเกิดปฏิกิริยาไปข้างหน้าหรือย้อนกลับจำนวนโมลของสารที่มีสถานะแก๊สภายในระบบก็ไม่เปลี่ยนแปลง เมื่อเปลี่ยนความดันอัตราการเกิดปฏิกิริยาไปข้างหน้าและย้อนกลับยังคงเท่ากันตลอดเวลา
การเปลี่ยนแปลงอุณหภูมิของระบบ
กรณีที่ 1 การเปลี่ยนแปลงอุณหภูมิกับภาวะสมดุลของปฏิกิริยาดูดความร้อน คือ ΔE มีค่าเป็นบวกในปฏิกิริยาดูดความร้อน เมื่อมีการเปลี่ยนแปลงอุณหภูมิจะทำให้ภาวะสมดุลเปลี่ยนไป ดังนี้
-
การเพิ่มอุณหภูมิ เมื่อเพิ่มอุณหภูมิของระบบ ระบบจะต้องปรับตัวไปในทิศทางลดอุณหภูมิของระบบลง โดยระบบจะดูดความร้อนไปใช้ในการเกิดปฏิกิริยามากขึ้น ดังนั้นเมื่อเพิ่มอุณหภูมิระบบปฏิกิริยาจะเกิดไปทางด้านดูดความร้อนมากขึ้น หรือเกิดปฏิกิริยาไปข้างหน้ามากขึ้น
-
การลดอุณหภูมิ เมื่อลดอุณหภูมิของระบบลดลง ระบบจะต้องปรับตัวไปในทิศทางเพิ่มอุณหภูมิของระบบลง ดังนั้นเมื่อลดอุณหภูมิระบบปฏิกิริยาจะเกิดไปทางด้านคายความร้อนออกมา หรือเกิดปฏิกิริยาย้อนกลับเพื่อเพิ่มอุณหภูมิของระบบขึ้น
กรณีที่ 2 การเปลี่ยนแปลงอุณหภูมิกับภาวะสมดุลของปฏิกิริยาคายความร้อน คือ ΔE มีค่าเป็นลบในปฏิกิริยาคายความร้อน เมื่อมีการเปลี่ยนแปลงอุณหภูมิจะทำให้ภาวะสมดุลเปลี่ยนไป ดังนี้
-
การเพิ่มอุณหภูมิ เมื่อเพิ่มอุณหภูมิของระบบลดลง ระบบจะต้องปรับตัวไปในทิศทางลดอุณหภูมิของระบบลง ดังนั้นเมื่อเพิ่มอุณหภูมิระบบปฏิกิริยาจะเกิดไปทางด้านดูดความร้อนหรือเกิดปฏิกิริยาย้อนกลับได้ดีขึ้น เมื่อความร้อนถูกใช้ไปมากขึ้นก็จะทำให้อุณหภูมิลดต่ำลง
-
การลดอุณหภูมิ เมื่อลดอุณหภูมิของระบบ ระบบจะต้องปรับตัวไปในทิศทางเพิ่มอุณหภูมิของระบบลง ดังนั้นเมื่อลดอุณหภูมิระบบปฏิกิริยาจะเกิดไปทางด้านคายความร้อนหรือเกิดปฏิกิริยาไปข้างหน้าได้ดีขึ้น เมื่อปฏิกิริยาคายความร้อนออกมาก็จะทำให้อุณหภูมิสูงขึ้น
โดย ผลของการเปลี่ยนแปลงอุณหภูมินั้น ถ้าเป็นปฏิกิริยาคายความร้อน การลดอุณหภูมิทำให้ผลิตภัณฑ์มากขึ้นและค่าคงที่สมดุลสูงขึ้น แต่ถ้าเป็นปฏิกิริยาดูดความร้อน การลดอุณหภูมิทำให้ได้ผลิตภัณฑ์น้อยลงและค่าคงที่สมดุลลดลง ส่วนการเพิ่มอุณหภูมินั้นจะทำให้ถ้าเป็นปฏิกิริยาคายความร้อน การเพิ่มอุณหภูมิทำให้ผลิตภัณฑ์น้อยลงและค่าคงที่สมดุลลดลง แต่ถ้าเป็นปฏิกิริยาดูดความร้อน การเพิ่มอุณหภูมิทำให้ได้ผลิตภัณฑ์มากขึ้นและค่าคงที่สมดุลเพิ่มขึ้น
Comments
Post a Comment